记忆是利用过去服务现在或将来的能力。记忆对我们的日常生活至关重要,它定义了我们是谁。没有记忆,我们将陷入一个永恒的现在。经历过后,记忆留存,这表明这个经历的内在表征储存在大脑中,并且之后可以重建并使用这种记忆。在1904年,从进化动物学家转为记忆理论学家的理查德西蒙,引入了术语“印迹”来描述这样的记忆表征。Semon定义一个印迹为“…易激物质由某个刺激产生的持久但主要是潜在的修饰……”。他提出了一个基本的“印迹形成法则”:“所有同时发生的激活……形成了相互连接的同步激活复合体,以印迹形成(engraphy)的方式起作用,也就是说,形成了统一的印迹复合体。” 因此,一个印迹粗略的等价于一个“记忆痕迹”。
Semon的创新思想被他同时代的人极大地忽视了。然而,他的理论预示了很多当代卓越的记忆理念。Semon将一个印迹定义为大脑状态某些方面的离线的(off-line)、物理的变化。但是当被要求推测一个印迹精确的神经机制时,他会谨慎地对待,“在我看来,将其引入分子领域……这是无望的事业。在我们目前所具备的知识阶段,我放弃这个任务”。
然而几年后,从遗传学转向心理学的卡尔·拉什利,试图系统地在哺乳动物大脑中定位印迹。在一项典型的研究中,拉什利训练大鼠多天,使其在迷宫中走一条独特的路线来收集奖励。假设支持这种迷宫路线记忆的印迹的某些关键成分位于皮质中,Lashley在不同的位置去除了大小不一的皮质组织,然后测试了大鼠对迷宫路线的记忆。尽管去除的皮质组织的数量与整体记忆障碍有关,但去除的皮质组织的位置却无关。经过30多年的搜索,拉什利也没有找到脑中的印迹,只好宣称它“难以捉摸”。
印迹研究的下一次飞跃始于唐纳德·赫布(Hebb),他是一名心理学家、记忆理论家,也是拉什利的学生,他发展出了细胞集群理论(类似于西蒙的印迹复合体)。赫布假设,如果一群相互连接的细胞在某个经历期间同时激活,它们就会形成一个细胞集群。细胞集群内的充足的活动会诱导生长和/或代谢变化,从而加强这些细胞之间的连接[可以提炼为“一起激发的神经元连在一起”( “neurons that fire together, wire together”)]。这些突触和代谢变化(也许包括神经元内在兴奋性的变化)对细胞集群的功能有影响。例如,仅仅细胞集群的一小部分的再活化理论上会导致整个集群的再活化。相比之下,销毁一小部分集群细胞并不一定会导致整个记忆表征的破坏(而是适当地降低)。有趣的是,西蒙(Semon)也为印迹提出了类似类型的印迹属性。
总之,这些(和其他)科学家共同帮助定义和描述了印迹。但是,很少有研究检测印迹的生物学基础。一百多年前,西蒙写道,检测一个印迹的神经生物学基础代表着一种“无希望的事业”。这可能不再成立。围绕印迹的近期兴奋研究可能直接源于新工具的开发,这些工具允许在单个细胞的水平上对细胞集群进行成像和操纵。我们首先简要回顾一下支持啮齿动物脑中存在印迹的神经生物学证据,以及我们不仅能找到而且还可以操纵印迹以更好地理解记忆的能力。然后,我们通过考察印迹研究的结果以及之前的记忆和可塑性研究结果来讨论印迹研究的现状。通过西蒙的指导,我们将印迹定义为对过去经验的持久、离线(off-line)的表征(方框1)。需要注意,印迹还不是记忆,而是为出现记忆提供了必要的物理条件。当适当的线索成功通过一个被Semon称为“兴奋痕迹复现(ecphory)” 的进程而激活印迹时,记忆便被提取了出来。
印迹定义:“印迹”是指持久的离线(offline)的物理和/或化学变化,这些变化是由于学习而引起的,并且是新形成的记忆关联的基础。“印迹细胞”是构成给定印迹的关键细胞成分的细胞群。这些细胞可能(也可能不是)也是支持其他记忆的关键组成部分。印迹细胞被(i)通过学习经历激活,(ii)通过学习经历进行了物理或化学修饰,并且(iii)通过随后呈现的在学习经历(或其某些部分)中出现的刺激而被激活,最终实现记忆提取。
“印迹细胞集合”是指位于一个大脑区域内的印迹细胞的集合。每个大脑区域中的印迹细胞集合相互连接,形成一个“ 印迹复合体”,这是整个大脑的印迹支持的记忆,该记忆存储在通过印迹细胞途径连接的不同大脑区域的印迹细胞集合中。
评估印迹的实验策略
为了评估记忆印迹的存在,我们采用了莫里斯和他的同事在其具有里程碑意义的论文中讨论的标准和实验策略,他们评估了突触可塑性在记忆中的重要性。具体来说,我们讨论了来自四类研究的证据。首先,支持啮齿动物脑中存在印迹的观察性研究应该表明:相同的(或重叠的)细胞群既可以通过经验被激活也可以通过这种经验的回忆而被激活,此外,学习应该诱导持久的细胞和/或这些细胞的突触的修饰。其次,功能缺失研究应表明,一个经历之后,该经历的印迹细胞的功能损伤,会损害随后的记忆提取。第三,功能获得的研究应表明,在没有任何自然感觉线索的情况下,人工激活印迹细胞可诱导记忆的提取。第四,模仿研究应该可以人为地将一个从未体验过的经历引入大脑,并且啮齿类动物可以利用这种人工印迹编码的信息来指导行为。
记忆痕迹,或至少生理相关的记忆,已经在许多无脊椎动物物种被研究,如蝇,章鱼,海兔,海蛞蝓,蜜蜂和海参。此外,哺乳动物的开创性研究极大地帮助了我们目前对记忆的神经基础的理解,但是没有在细胞整体水平上考察记忆。这里的讨论主要限于啮齿动物实验,考察显性经验的记忆,从而在印迹水平上探究记忆。
观察研究
通常,观察研究利用即刻早期基因(IEGs),例如c-Fos,Arc(活性调节细胞骨架相关蛋白),或Zif268(锌指蛋白225)来可视化激活的神经元。在记忆测试中激活的细胞使用IEG免疫组织化学进行标记,而在训练过程中激活的细胞则通过使用时间诱导型IEG启动子来“标记”,这些IEG启动子可以通过驱动更持久的荧光(或其他)报告蛋白的表达。一个大脑区域(或整个大脑)中这两个细胞群(“在训练中激活”和“在测试中激活”)之间的高于随机水平的荧光重合,就是印迹。
在一项旨在从细胞群体水平检测记忆的初步观察性研究中,Mayford及其同事标记了在听觉恐惧条件下激活的神经元。该常用的记忆任务,通常在一个条件环境中,将最初无害的音调(条件刺激)与厌恶性电击配对(非条件刺激)。当随后将其再次暴露于声音或条件环境时,啮齿动物会产生冻结反应(主动的,习得的条件反应),显示出对训练经验的记忆。在该实验中,训练3天后把小鼠放回该环境,并用zif268免疫组织化学标记被恐惧回忆激活的神经元。与支持这种条件性恐惧记忆的印迹的存在相一致,基底杏仁核中在训练(标记)和测试(zif268 +)过程中激活的神经元重叠超过了随机水平(约占总细胞的11%)。
利用各种不同的记忆任务(包括情境条件恐惧,听觉条件恐惧和新奇物体探索),并使用不同的标记方法,最终可以在多个脑区[包括背侧海马,杏仁核,和皮层]得到相似的结果。对照研究显示,标记的细胞仅通过相应的条件刺激而被激活,而不会被与训练经历无关的刺激而激活。总体而言,尽管大多数观察性研究并未直接解决Semon假设的持久性、习得性变化,但这些结果(以及方法、任务和实验室之间的显著一致性)为印迹的存在提供了广泛的支持。然而,因果研究是必要的,以表明这些重新激活的潜在印迹细胞确实是一种内部体验表征的一部分。
功能缺失研究
功能缺失研究试图在记忆力测试之前“捕获”印迹细胞,并特异地破坏其功能。Josselyn及其同事在细胞群体水平上进行了首次功能缺失记忆研究。一种分配策略用于捕获外侧杏仁核(LA)中支持小鼠的条件性听觉恐惧记忆的潜在印迹细胞。这种策略是,使用表达CREB(Ca++/cAMP响应元件结合蛋白)的嗜神经病毒,可以将一小群随机的LA神经元偏向地包含(或分配)到印迹中。CREB是一种转录因子,可增加神经元兴奋性和树突棘密度。先前的研究证明,高表达CREB的神经元更容易被编码入印迹中。因此,假设感染了此CREB载体的神经元偏向于包含在印迹中。既表达CREB(用于分配神经元)又产生可诱导细胞自主凋亡的病毒被用来在训练后特异性杀死分配的神经元(印迹)。凋亡过表达CREB的神经元破坏了动物在声音线索出现后的恐惧冻结行为,就好像记忆被擦除了一样(图1)。重要的是,小鼠能够学习新的条件恐惧任务(表明整体LA功能未受到损害),并且凋亡相似数量的非CREB过表达的细胞(非印迹细胞)不会破坏记忆(显示在细胞水平上的记忆破坏的特异性)。
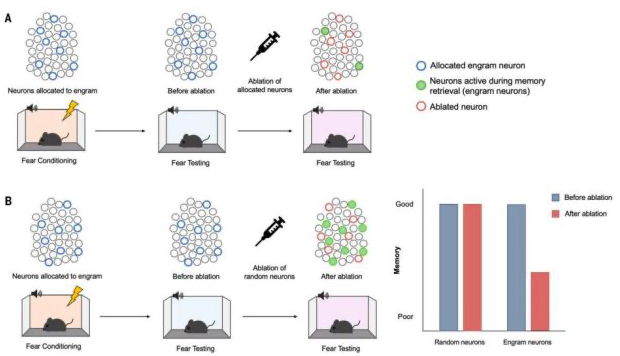
图1 印迹功能缺失研究阻断了随后的记忆提取
(A)凋亡分配的神经元。外侧杏仁核中转录因子CREB过表达的主要(兴奋性)神经元被分配为印迹细胞(蓝色圆圈))。小鼠接受了条件性听觉恐惧,在此期间音调(条件刺激)与足底电击(非条件刺激)配对。大多数分配的神经元在恐惧记忆测试(绿色实心圆圈)中处于激活状态,这表明分配的神经元优先被招募到支持这种条件恐惧记忆的印迹中。在第二次记忆测试之前,特异性凋亡实验分配的神经元(红色圆圈)可以破坏记忆提取。(B)随机凋亡相似数量的未分配的神经元不会破坏记忆提取。
随后的研究使用了多种方法,在多个记忆任务中,永久或可逆地失活多个印迹相关脑区中分配或标记的神经元,得到了类似的结果。总之,这些发现表明,在某个经历中激活的神经元成为印迹细胞是后续记忆表达所必不可少的(或某种程度上是必需的)。
为什么拉什利(Lashley)没有找到印迹,而这些功能缺失得研究却可能成功地找到了?首先,Lashley可能使用了不合适的行为测试来探查印迹。Lashley使用的迷宫任务小鼠可以使用不同的策略来解决,因此可能对损坏某个特定大脑区域不敏感。其次,对于这种类型的空间记忆任务,拉什利可能靶向了错误的大脑区域。
功能获得研究
功能获得性研究试图在缺乏自然线索的情况下,通过人工激活印迹细胞诱导记忆提取。Tonegawa及其同事提供了印迹存在的第一个功能获得证据。在情境恐惧条件下激活的海马齿状回(DG)神经元(在情境中与足底电击偶联)被标记并表达兴奋性视蛋白通道视紫红质2(ChR2)。在非训练环境中进行测试时,小鼠没有冻结反应。然而,即使小鼠从未在这种非训练环境中受到电击,光激活带标记的印迹细胞也足以诱导冻结反应,这而冻结是学习特有的条件反应。重要的是,光诱导的冻结不是由于先天的、不需要学习的神经回路的激活或简单的反射反应引起的,因为如果在训练期间使下游CA1神经元沉默(从而阻止学习),则光激活标记的DG神经元的不能诱导冻结。
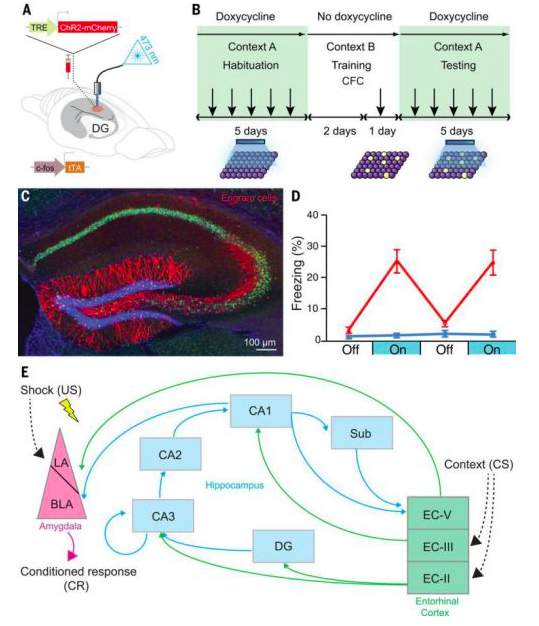
图2 用于印迹区分和印迹群体分布的功能获得方法
(A)向c-fos-tTA转基因小鼠注射AAV9-TRE-ChR2-mCherry(允许在没有强力霉素的情况下激活神经元表达兴奋性视蛋白ChR2),并植入光纤以靶向蓝光激活DG中表达C hR2的神经元。(B)基本实验方案。将小鼠环境A中适应,持续5天给强力霉素并给光刺激,然后撤掉强力霉素(以打开标记窗口),放置在条件恐惧(CFC)的环境B中2天。之后将小鼠放回强力霉素下(以关闭标记窗口),并在环境A下用光刺激测试5天。(C)代表图像显示了撤去强力霉素2天并接受CFC训练的小鼠中ChR2-mCherry阳性(红色)印迹细胞的表达。(D)在环境B的CFC中印迹细胞表达ChR2的小鼠(红色)比环境A的对照组(表达mCherry)表现出更大的冻结反应。(E)一部分条件性环境恐惧相关的印迹细胞集群。通常认为,特定记忆的印迹分布在一个以上的大脑区域。例如,对于环境的恐惧记忆,内嗅皮质层II(EC-II)以及海马亚域[DG,CA3,CA2,CA1和下托(Sub)]中的印迹集群可能表征环境,而杏仁核细胞集群表征恐惧信息。这些印迹集群在功能上连接以形成印迹复合体。因此,出现了一个概念,即印迹复合体中特定的细胞连接模式充当特定记忆的基础。US,无条件刺激;LA,外侧杏仁核;BLA,基底外侧杏仁核;CS,条件刺激。
在各种任务中,通过光遗传学或化学遗传学重新激活不同脑区标记的或分配的印迹细胞,可以在没有额外感觉线索的情况下诱导记忆表达。因此,人为再激活印迹细胞可作为诱导记忆表达的充分线索,来“唤醒”休眠的印迹,类似于Semon最初对兴奋痕迹复现的定义[“将记忆痕迹或印迹从其潜伏状态唤醒”]。
模拟实验
在自然记忆提取过程中,感觉条件刺激(例如训练环境)被认为可重新激活印迹细胞以诱导记忆提取。第一项功能获得研究被设计为通过光遗传学刺激直接重新激活印迹细胞来模仿这种提取过程,从而规避了对条件刺激的需求。即,人工刺激代替了自然条件刺激以诱导记忆提取。印迹细胞的光遗传刺激也用于在形成新记忆的过程中人为地恢复以前经历过的感觉刺激。例如,当小鼠在探索新环境(环境A)期间激活的DG神经元,后来在另一环境下(环境B)接受足底电击时被光激活。在记忆测试中,即使在环境A下从未受到电击,小鼠也会表现出恐惧的冻结反应。即,小鼠提取了人工的虚假记忆。小鼠仍会在环境B中冻结(显示了自然记忆提取)。但在第三类环境中(环境C)小鼠不会冻结。由“自然”和“人工”手段产生的两个记忆只能通过它们各自的条件刺激来提取,表明这两个记忆都保留了它们的特质。类似于复合条件刺激(其中声音和光线都可以预测足底电击),在这里,自然记忆和人工记忆的强度大约是单个“正常诱导”记忆的50%,这表明自然条件和人工条件刺激之间存在线索竞争。因此,当动物正在提取先前形成但可能不相关的记忆时,如果发生生物学上重要的事件(例如,足部电击)时,动物可以将这两个刺激关联起来以形成新的但错误的情节记忆。类似的机制可能是人类错误记忆的基础,先前获得的记忆将通过自然过程来提取。
Mayford及其同事使用了类似的方法,当小鼠探索新的环境(环境A)时,标记了整个大脑活跃的神经元。当小鼠在条件恐惧的环境B中冻结时,用化学方法重新激活标记的神经元会产生“混合或合成”的情境表征,而这在以上两种环境都无法单独获得。但是,小鼠在测试中会在更类似环境B的A环境中冻结,表明该混合记忆结合了自然和人工线索。人工印迹再激活的时空特性的差异(更急性地光遗传激活局部标记的DG神经元相比较较长期的化学遗传激活大脑中非局部标记的神经元)可能解释了这两种人工条件刺激研究的不同结果。
在非条件刺激的表征过程中被激活的神经元也已被标记并被人工激活。在环境A探索期间(条件刺激)和足底电击(非条件刺激)活跃的神经元集群分别在海马CA1子区和杏仁核的基底外侧复合体中被标记。当老鼠在笼子里时,同步光遗传激活这些集群就足以产生错误的记忆。之后,小鼠在环境A(无电击)的环境中会冻结,就像条件刺激和非条件刺激已经偶联一样。
最后,最近的一项研究调查了在完全不存在自然刺激(条件刺激或非条件刺激)的情况下,是否可以通过人工方式植入记忆。要成为真正的记忆植入,这样的实验应满足多个条件:首先,“学习经验”应该通过例如直接刺激假定的条件刺激和非条件刺激神经通路而完全在大脑中发生。其次,应该通过呈现“真实的”外部线索(而不仅仅是内部神经线索)来证明植入式记忆的存在。最后,该记忆的行为表征应反映出预测的记忆内容,并且只能通过脑中“训练过的”条件刺激来提取(不通过其他相似的线索)。在这项研究中,将一种遗传特异性的嗅小球通过光遗传刺激(条件性刺激)与愉悦或厌恶性神经通路的光遗传刺激(非条件性刺激)偶联配对。经过这种完全的颅内条件配对后,小鼠对激活该种嗅小球的真正气味分别表现出偏好或厌恶感。简而言之,在没有经验的情况下产生了记忆。这些结果满足由Martin和他的同事提出的模拟标准,并且因此,提供了有说服力的记忆痕迹存在的另一条证据。
通过印迹理解记忆
印迹的“持久变化”
在体内标记编码特定记忆的印迹细胞的技术,为研究Semon提出的“持久变化”的性质提供了机会。由赫布关于突触可塑性(神经元之间的突触强度增加)在记忆中的关键作用的理论指导下,Tonegawa及其同事证明,学习增强了突触强度,特别是在印迹细胞中。首先,训练后1天,在情境恐惧条件下标记的海马DG颗粒印迹细胞比非印迹DG细胞显示出更高的突触强度[较高的AMPA / NMDA比]和树突棘密度增加。其次,与非印迹CA3细胞相比,下游CA3 印迹细胞在功能上与上游DG 印迹细胞相连。此外,Kaang及其同事表明,在情境恐惧条件下标记的从CA3印迹细胞接受输入的CA1印迹细胞上的棘的数量和大小均大于非印迹CA1细胞上的棘的数量和大小。CA3和CA1印迹细胞之间的这种区域间连通性的增强与记忆强度和长程增强(LTP)相关,表明内源性地发生了LTP样现象。类似地,听觉恐惧条件期间标记的LA印迹细胞表现出与突触前神经元增强的突触连接。最后,缩小支持某个运动记忆的初级运动皮层(M1)印迹细胞中的突触,便破坏了其随后的该运动记忆性能,而不是类似的运动记忆。总之,这些研究开始将先前关于突触可塑性与印迹的研究整合在一起,并表明,印迹细胞之间的优先连接是学习导致的印迹持久变化的关键部分。总的来说,这些发现进一步印证了赫布公理:一起激发的神经元连在一起。
分布式印迹集群
尽管在印迹研究中经常检查一个特定的大脑区域,但是通常来说支持特定经历的印迹可能会广泛分布在整个大脑中。不同大脑区域中的印迹细胞集群可能支持体验的不同方面。例如,在情景恐惧记忆,海马(DG,CA3和CA1)印迹细胞集群可表征环境,而杏仁核印迹细胞集群可以表征情绪效价信息,而皮质印迹细胞集群可以表示不同的感觉信息。
许多研究考察了整个大脑中支持情景恐惧记忆的印迹细胞集群。例如,弗兰克兰德(Frankland)及其同事比较了近期(训练后1天)与远期(训练后36天)的环境恐惧记忆提取中,被激活的细胞在全脑(84个大脑区域)的分布。在共激活的基础上,使用图论来构建功能连接组学的“记忆地图”,并识别在记忆提取中的枢纽区域。随后的化学遗传学抑制研究证实,这些鉴定出的枢纽区域对于后续的记忆提取是必需的。Luo及其同事结合使用了印迹标签技术[活动类群2靶向重组(TRAP2)转基因小鼠]和IEG免疫组织化学技术,以检查在情景恐惧训练和测试中激活的神经元之间的重叠,从而发现了远期(14天)相比近期(1天)在环境恐惧记忆提取中,有更多的前边缘皮层神经元参与,这表明一个印迹随时间变化。最后,一项初步研究标记了小鼠409个大脑区域中表征情境恐惧条件记忆的候选印迹集群。Roy及其同事使用称为SHIELD的CLARITY样组织透明技术在同一只小鼠中标记了在训练中活跃并且在回忆时激活的整个大脑中的细胞,这样就可以立即对整个完整的大脑进行成像。这些研究人员从激活数据中得出了一个“印迹指数”(定义为给定大脑区域中的细胞在记忆编码和提取中激活的程度),从而可以对不同大脑区域进行等级排序。使用光遗传学和化学遗传学方法来考察具有高印迹指数的人工激活区域的效果,这项研究表明,许多印迹集群在功能上是连接的,并会被一个经验同时激活。这些发现表明,一个经验可以通过分布在多个大脑区域、有特殊连接的多个印迹集群来表示,并为Semon的“统一印迹复合体”假说提供了实验支持。
印迹,位置细胞和睡眠
CA1位置细胞表现出位置特异性的发放模式。稳定的位置细胞对于支持空间或环境记忆的印迹可能至关重要。最近,McHugh及其同事对比了CA1位置细胞和印迹细胞在记忆中的作用。在小鼠探索新环境的同时,他们标记了印迹细胞,并使用四极体电极记录识别了位置细胞。多数标记的印迹细胞也是位置细胞,但大多数位置细胞未被标记上 。未标记的位置细胞的行为类似于传统的位置细胞(在相同的环境中稳定,但在新的环境中重新映射)。相比之下,标记的位置细胞(与印迹重合)只在特定环境发放,空间信息不精确,并且在新的环境中不被激活(不重新映射)。因此,印迹细胞可能可以提供一般的环境信息,而未标记的位置细胞则可以提供精确的空间信息。
海马位置细胞放电的编码后激活或回放,特别是在慢波睡眠(SWS)期间,对于记忆巩固至关重要。在SWS期间,海马神经元以一种振荡节律(称为尖波涟漪)发放,往往与皮质神经元(称为纺锤波)的节律发放同时发生。如果破坏尖波涟漪-纺锤波耦合或尖波涟漪相关的海马位置细胞回放,则会损伤动物回忆。这些有节律振荡对印迹细胞的确切作用尚不清楚。尖波涟漪促进海马CA1区的神经元的突触抑制。最近的一项研究表明,在环境探索期间标记的CA1印迹细胞比非印迹细胞更有可能参与尖波涟漪事件,也许可以使这些印迹细胞逃脱SWS诱导的突触抑制。通过这种方式,在振荡节律期间印迹细胞的编码后重激活可能可以通过减少记忆巩固过程中非印迹神经元活动导致的 “噪声”,从而使印迹细胞对记忆的编码更加精确。
印迹的寿命
印迹的诞生
约瑟琳,席尔瓦及其同事发现,在印迹形成的过程中,给定大脑区域中合格的神经元会相互竞争,以分配(或募集)印迹。具有相对增加的固有的神经元兴奋性的神经元会赢得这场分配竞争并成为印迹细胞(图3)。基于兴奋性的竞争性印迹分配也发生在其他大脑区域,并支持不同类型的记忆[例如,海马背侧CA1区和前额叶皮层(情景恐惧记忆),岛状皮层(条件性味觉厌恶记忆)和压后皮层(空间记忆)]。
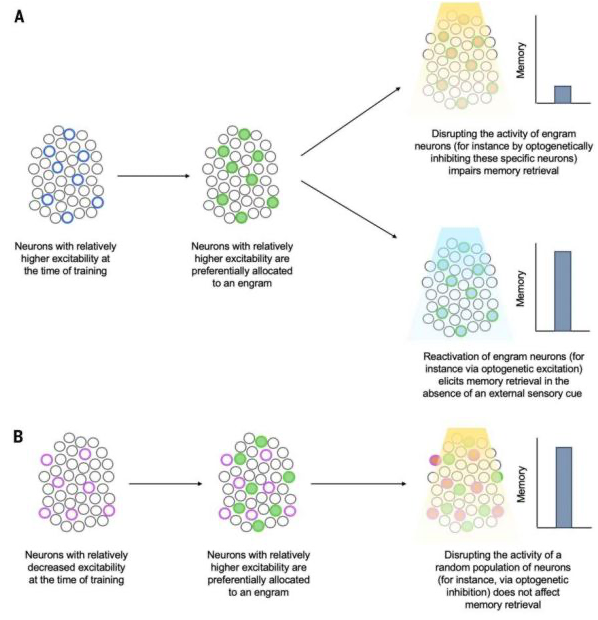
图3 神经元分配给一个印迹
神经元会竞争支持记忆的印迹的分配,而训练时相对兴奋性增强的神经元“赢得”了分配竞争。(A)在训练时内源性兴奋性比其邻居更高的神经元,或通过实验操纵而变得相对更兴奋的神经元(蓝色圆圈)优先分配给一个印迹(绿色实心圆圈)。这些分配的或神经元神经元的随后破坏会破坏记忆恢复(右上),而在没有正常感觉恢复线索的情况下,这些神经元的人工激活会引发记忆恢复(右下)。(B)在训练时(内源性或通过实验操作)兴奋性相对降低的神经元(紫色圆圈)优先从印迹(绿色实心圆圈)中排除。随后阻断未分配的或非印迹神经元则不会影响记忆提取。
除了厌恶记忆,在训练过程中人为导致更兴奋的LA神经元也被优先分配给支持可卡因线索奖励记忆的印迹。同样,根据训练经历的不同,随机增加一小部分的梨状皮层主神经元的兴奋性,可以导致它们被分配给支持奖励性或厌恶性嗅觉记忆的印迹。基于兴奋性的神经元印迹分配是内源性产生的,可以由计算机建模预测,并且是与先前研究无脊椎动物的记忆痕迹形成中的固有兴奋性一致的。这些发现加在一起表明,在任何给定的时间,在某些大脑区域中,一小部分的神经元都会被“优先”成为印迹的一部分(如果有经验发生),而与经验的正负性效价无关。
尽管海马背侧CA1区的稳定细胞和印迹细胞有所不同,但其形成的某些机制可能是共有的。在给定的环境中,CA1神经元的一小部分是位置细胞,因为大多数CA1神经元是沉默的。在放入新环境中之前,有着相对较高的兴奋性的神经元更容易成为在该环境中的位置细胞,而通过实验升高初始沉默细胞的兴奋性也可使之偏向于成为一个位置细胞。
有趣的是,当前印迹分配研究与之前的选择性稳定研究在数据上具有一定相似性。选择性稳定提出在大脑中内源地产生多种前表征,并且在任何给定的时间点仅选择一种或几种适合这种情况的细胞来控制行为和/或持久性。分配和选择性稳定都与达尔文竞争的概念框架有着一致性。
观察和标记实验研究与计算理论一致,即印迹是稀疏编码的。也就是说,并非给定大脑区域内的所有神经元都会变成支持特定记忆的印迹细胞。不同记忆强度中,给定大脑区域内的印迹大小(即印迹细胞数)是稳定的,并且不会改变。例如,听觉恐惧条件记忆和可卡因记忆中一个LA印迹的大小(LA印迹细胞数)是相似的,而且记忆强度不会影响印迹大小。事实是,更强的记忆意味着印迹细胞之间的更大量的突触。
一些证据表明,一种限制印迹大小的机制涉及抑制性神经元。因此,在基底外侧杏仁核复合体中抑制PV中间神经元的活性,可以增加听觉恐惧记忆的LA印迹的大小。这是通过一个双突触抑制的过程实现的。其中兴奋神经元通过中间抑制神经元来抑制另一个兴奋神经元。此外,通过类似侧向抑制的过程,抑制含有生长抑素的中间神经元会增加DG情景恐惧记忆印迹的大小。在人体研究中也强调了抑制性神经元在印迹中的重要性。例如,证据表明,在皮质中,联想记忆以兴奋性印迹和匹配的(相等或相反)抑制性印迹表征。记忆是在兴奋性印迹被去抑制后提取的。为了理解这些相反的作用如何相互作用以支持记忆功能,有必要进一步研究在印迹的形成、存储和提取中的兴奋-抑制平衡。
记忆丢失中的沉默印迹
印迹可能会损坏,从而使记忆永远丧失。但是,印迹也可能暂时无法访问,此时该印迹仍然存在,但无法通过自然方式提取。沉默的印迹,不能通过自然提取线索激活,但可以通过直接光遗传学刺激提取到。这首先在一项实验中得到揭示。该实验中,在小鼠进行情境恐惧条件后立即使用蛋白质合成抑制剂茴香霉素。在一个经验之前或之后立即抑制蛋白合成已知会诱发健忘症,并阻断细胞巩固。细胞巩固是指记忆稳定中一个相对较快的过程,该过程涉及增强突触所必需的基因的表达。相比之下,系统巩固(在下面讨论)指的是分布式大脑环路上较慢的,时间依赖的记忆重组。
在一项研究中,训练后立即施用茴香霉素的小鼠在训练后1天被放回训练环境时几乎没有冻结现象。因此,就如预期的那样,破坏蛋白质合成可通过阻止细胞巩固来诱导逆行性健忘症。然而,通过光遗传学再激活在情境恐惧训练期间标记的DG印迹神经元足以恢复记忆,即使在训练后8天也是如此(图4)。这些结果表明该印迹已形成并可以持续数天,但该印迹无法自然地提取。沉默的DG印迹细胞显示出比正常的印迹细胞(对照小鼠)更弱的生理(突触强度增加)和结构(树突棘密度增加)改变,这表明沉默的印迹可能是破坏正常训练所引起的突触增强的结果。DG印迹细胞的光遗传激活能够诱导记忆恢复,这表明直接的光遗传激活能够绕过印迹细胞内突触和结构可塑性的这一要求。与此一致,通过基因手段恢复树突棘密度也可以使沉默印迹被重新激活,并且记忆重新可以被自然提取信息激活。
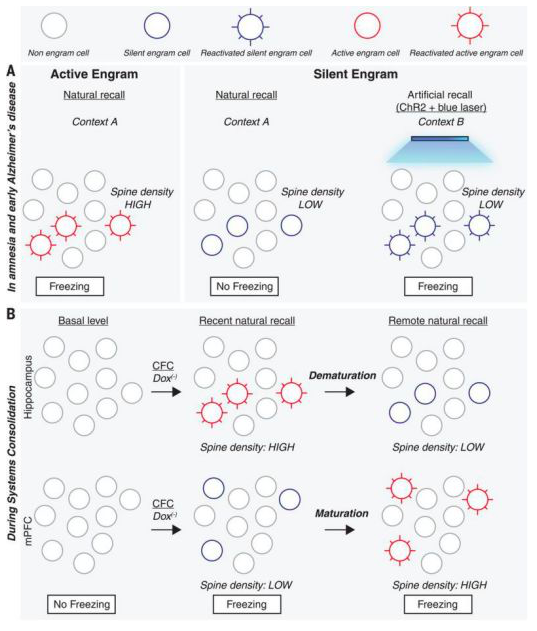
图4 健忘症中和记忆系统巩固期间的活跃和沉默的印迹细胞。
(A)活跃的印迹细胞具有较高的树突棘密度,并可以在条件环境A中被激活以产生条件反应,即冻结。在失忆症和用于模拟早期阿尔茨海默氏病的小鼠模型中产生的沉默印迹细胞显示较低的树突棘密度,无法在条件情境A中激活以产生条件反应,但是如果这些细胞在编码过程中被使用ChR2标记,则可以在非条件情境B中被蓝光激活。(B)在记忆系统巩固过程中,在进行情境恐惧条件期间,海马中形成了具有高树突棘密度的活跃印迹细胞,并且持续数天,条件环境会引起条件响应。但是,到两周后(远期回忆),这些海马印迹细胞去成熟而变得沉默,树突棘密度降低。在mPFC中,在CFC期间会形成印迹细胞,但它们是低树突棘密度的沉默印迹。在接下来的2周内,这些mPFC沉默印迹细胞获得更高的树突棘密度,并成为活跃的印迹细胞。
可以通过破坏突触效力和树突棘密度来使印迹沉默,并通过增强突触可塑性来唤醒印迹。这种想法与一项通过探究听觉恐惧条件的非印迹研究的发现相一致 。在一种听觉恐惧条件任务的变体任务中,声音条件刺激被光遗传激活LA中来自内侧膝状体和听觉皮层的神经元轴突末端所取代。条件恐惧后,研究者立即对大鼠进行长程抑制(LTD)样的光遗传学刺激。LTD被认为会削弱突触功效并降低树突棘密度 。与类似LTD的刺激会使印迹沉默一致,此光致LTD刺激会损害后续的记忆回忆。但是,类似LTP的光遗传学刺激可以使记忆得以恢复(即印迹“未沉默”)。即,随后的LTD样光遗传刺激使该记忆沉默,而LTP样光遗传刺激使该记忆恢复。
这些发现提出了这样一个问题:在其他失忆情况下的印迹(及其支持的记忆)是否真的“丢失了”,或者仅是由于无法访问,从而在自然条件下无法提取。人工刺激激活沉默印迹的印迹细胞的实验,是用研究初期阿尔茨海默氏病(AD)的遗忘小鼠来做的。这些转基因小鼠表现出环境恐惧记忆障碍。然而,通过光遗传学ChR2标记DG印迹细胞,重新激活印迹细胞诱导了与对照小鼠相当的冻结反应。与其他沉默印迹细胞例子相同,这些用于研究AD的小鼠的DG印迹细胞显示出树突棘密度降低。然而,LTP样光遗传学刺激输入到DG神经元细胞的内嗅皮质神经元印迹细胞,不仅可以恢复DG神经元细胞中的树突棘密度,而且还恢复了自然提取线索引起的记忆提取的能力(从而使印迹去沉默)。在小鼠中的这些发现与人类早期AD记忆提取可通过特定线索被增强一致。因此,在某些情况下,AD人类可以提取到以前无法访问的记忆,这就是说早期AD大脑中的某些印迹可能是保持沉默而不是彻底丢失。
除了临床意义外,沉默印迹的发现还和记忆存储与提取中依赖蛋白质合成的细胞巩固作用有关。关于此问题一直存在争论。大多数研究细胞记忆巩固的神经科学家赞成破坏蛋白质合成会破坏记忆存储的观点。但是,在许多健忘症实验中,记忆存储与记忆提取混为一谈。即使在训练后1周,用光遗传学刺激健忘症小鼠的沉默印迹也能诱导记忆提取,这一发现挑战了依赖蛋白质合成的细胞巩固对记忆存储很重要的观点。这些发现反而表明,细胞巩固的作用是增强了印迹的后续可提取性,这与在记忆形成后建立印迹的“提取开关”的想法一致,并且记忆提取后可能会进行重构。重要的是,沉默印迹的观点与开创性的认知心理学家恩德尔·图尔文(Endel Tulving)在记忆可用性和可及性之间的概念区分是一致的,他提出记忆力衰竭即可能反映出信息的缺失也可能是由于难以访问到信息。
正常记忆中的沉默印迹
记忆可能会随着时间和情况而变化。记忆的这些变化是否可能由内源性印迹沉默来介导?一项社交辨别任务可以对此进行探索,在该任务中,老鼠会倾向与一只新的而不是熟悉的老鼠互动。这种社交辨别记忆在接触到熟悉的老鼠后(训练经历)大约持续一个小时,而在训练后24小时则消失。背侧CA2到腹侧CA1(vCA1)海马回路在社交辨别中起着关键作用,其中vCA1的印迹代表熟悉的小鼠)。与社交辨别记忆的时间过程一致,在训练后一个小时,vCA1中关于熟悉小鼠的印迹会变得沉默。但是,在训练后24小时(当正常情况下社交辨别记忆已消失时)人为地激活该印迹会恢复社交辨别记忆,就好像回忆起了曾经熟悉但已经遗忘的小鼠一样。除了人工进行印迹重新激活,小鼠共养等干预措施也延长了vCA1印迹(和社交辨别记忆)的可访问性。这些发现提示,印迹沉默可能是大脑正常调节记忆过程的一种方式。
关于记忆消退的研究提供了其他证据。条件恐惧后,单独重复施加条件刺激(在没有非条件刺激(电击)的情况下)会导致对条件的响应逐渐降低,这种现象称为消退。因此,在消退训练后,条件刺激诱导记忆恢复的能力减弱,这种结果在现象学上与印迹沉默类似。印迹沉默可能会导致消退吗?与这个想法一致的是,一些听觉恐惧消退实验可以诱导LA神经元突触去增强,即相反于由恐惧条件诱导的突触增强。此外,在恐惧条件之后,LTD样电刺激投射到LA的外囊突出末梢可以诱导突触去增强并减少恐惧行为,类似于消退和印迹沉默。最后,在消退训练后不久,人工激活在情境恐惧训练过程中被全脑标记的细胞(假定的恐惧印迹)可以增加小鼠冻结水平,这表明之前的恐惧印迹在消退过程中被沉默了。印迹沉默和消退之间的这些相似之处,也与消退期间条件刺激-非条件刺激之间的偶联将会在某种程度上消失的理论观点一致。
然而,其他人强调,消退并非反映改掉原来的条件联结(也许是通过沉默之前的印迹)而是体现了学习到一种新的“条件刺激-非条件刺激”与相应的新的消退印迹产生了联结。研究发现在消退训练后,如果条件刺激出现在(i)新的非消退环境中,(ii)在受应激后,或(iii)随时间的流逝自发恢复。最近的一项研究得出结论,情景恐惧消退可能源于DG中的一种新颖的恐惧消退印迹,它不同于并会抑制之前的情景恐惧印迹。该实验中,在消退训练后,远期(29天)观察到了消退记忆的自发恢复,但近期(6天)没有观察到。此外,消退训练后,在远期但不是近期的记忆测验中重新激活了最初的恐惧印迹。在消退训练后标记的激活细胞中观察到相反的结果模式(恐惧消退印迹)。有趣的是,恐惧消退印迹的人工重新激活阻止了原始恐惧记忆的自发恢复,即使经过了很长时间。这些结果表明,原始的恐惧印迹和消退印迹之间会争夺行为控制权。消退印迹首先压制或使原始的恐惧沉默,但随着时间的流逝,恐惧消退印迹本身也逐渐沉默。反过来,激活远期DG条件恐惧印迹(条件恐惧训练25天之后标记)或许对后续的恐惧记忆消退很重要。然而,情景恐惧条件训练后25天被激活的DG神经元与训练期间激活的DG神经元在何种程度上是同一群仍是一个开放的问题。
最后,最近的一项研究探究了杏仁核中的恐惧消退印迹,并发现该消退印迹细胞与训练期间的恐惧印迹在遗传上不同,且是基底杏仁核神经元中具有“奖励响应”的一部分神经元亚群。这些恐惧消退印迹细胞抑制了基底杏仁核中的恐惧印迹神经元。此外,当通过光遗传学激活这群细胞时会诱发欲求行为。在小鼠中的这些发现与近期对果蝇的研究结果一致,都突出了物种间恐惧消退与奖励过程之间的相似性。此外,这些结果也与行为控制中记忆痕迹之间的竞争是一致的。
沉默印迹和时间
大脑中记忆的表征可能会随时间而变化。例如,在训练后的几天(而不是训练后的几周)内损毁啮齿动物的背侧海马会破坏环境恐惧记忆的表达。在更远期,包括前扣带回皮层或内侧前额叶皮层(mPFC)在内的皮质区域会起主导作用。时间依赖重组的记忆可以反映系统巩固,该过程通常是指初始的基于的海马的情景记忆。最近的研究在海马和内侧前额叶皮质的印迹的水平考察了系统巩固,发现激活的印迹随着时间沉默,并且沉默的印迹会转化为激活的印迹。在情境恐惧条件训练中,激活的mPFC神经元被标记表达ChR2。当置于条件环境下时,训练后2天或13天进行测试时,小鼠表现出稳定的冻结反应。但是,支持记忆提取的印迹集群组件随测试时间的变化而变化。训练后的13天(而非2天),被标记的mPFC神经元被重新激活,这表明mPFC标记在训练后不久就保持沉默,在经过更长的延迟后才重新激活。DG印迹细胞具有相反的模式。训练后不久,DG印迹细胞被重新激活,但长时间之后则变得沉默。与上面讨论的沉默印迹的情况类似,训练后不久的mPFC印迹细胞和训练后较长延迟的DG印迹细胞均显示降低的树突棘密度,而且,这些沉默印迹的光遗传激活足以诱导记忆提取。有趣的是,训练后使用破伤风毒素诱导从DG印迹细胞到对mPFC印迹细胞的输入的抑制,会阻止沉默的mPFC印迹细胞成熟到可访问的状态,这表明不同的印迹集群组件之间的协调网络功能在系统巩固中很重要。
记忆也可能变得不那么精确,并且会随着时间的流逝而更加泛化。据记忆变换理论,记忆的神经表征的变化意味着记忆性质和质量的变化,即随着时间的推移,从特定的海马依赖性的环境特异的详细记忆转化成在皮质结构中的主旨式的大略记忆。可以在印迹级别控制远期记忆泛化的神经过程,表明DG 印迹的可用性对于记忆特异性至关重要。在一项实验中,在进行情境恐惧条件训练后不久(1天),小鼠仅在训练环境中冻结,而在更远的时间后(训练后16天),小鼠也会在非电击环境中冻结。在近期而非很遥远的时间,相比非印迹细胞,DG印迹细胞会与表达小清白蛋白的CA3篮状细胞具有更大的连通性(从而通过前馈抑制作用抑制了CA3锥体神经元),这表明DG-CA3回路中更大的前馈抑制作用有助于维持记忆精度。有趣的是,在训练后第10天光遗传激活DG印迹细胞不会诱导记忆恢复(这表明该印迹已难以利用),除非通过遗传增强了对CA3锥体神经元的前馈抑制作用。总之,增强CA3锥体神经元的前馈抑制作用可以保持DG印迹细胞的可用性,并延迟远期记忆中环境特异性记忆的丧失。
这些发现表明,印迹沉默可能代表了印迹自然状态一种连续统。也就是说,一个印迹可能是(i)不可用(自然条件刺激或人工激活都不会诱导记忆表达),(ii)沉默(仅人工激活足以诱导记忆表达),(iii)休眠或潜伏,如最初Semon所述(自然条件刺激可能引起记忆提取),或(iv)激活(当前正在提取)。不同的过程可能会介导这些不同的印迹状态。例如,类似于沉默一个DG印迹,训练后的茴香霉素给药会使支持听觉恐惧记忆的LA印迹沉默。但是,除茴香霉素外,如果在训练后还施用了一种诱导自噬的肽(诱导蛋白质降解),则光遗传学再激活LA的输入也不再足以诱导记忆恢复,这表明自噬使印迹无法使用,而不是简单的无法访问。
从印迹到知识
到目前为止,我们已经讨论了支持单个记忆的印迹。当然,动物(包括人类)能够学习并记住许多事情。我们也希望把其中的一些经历中独特的情节牢牢记住,希望这些情节充满细节。但是,在其他情况下,将相关经验联系起来,从而创建一个总体概念或原则可能会更加有利。这就提出了一个问题,即代表不同经历的印迹如何相互作用。控制将单个经验分配为印迹的神经元机制也可以用于将神经元分配给共同的印迹(从而链接经验),或者将神经元分配给不重叠的印迹(从而使经验消歧)(图5)。这样,相对神经元兴奋性不仅对于最初的印迹形成至关重要,而且对于组织整个大脑的不同记忆表征也至关重要。

图5 神经元分配和记忆链接。
在事件1时(蓝色)兴奋性增强的神经元被分配为支持该记忆的印迹(蓝色实心圆圈,橙色轮廓)。在事件1之后的几个小时内,这些分配的印迹神经元保持比其邻居更高的兴奋性。如果在此期间发生了类似的事件2(绿色),则分配给支持事件1的印迹神经的兴奋性更高,因此也分配为支持事件2(橙色轮廓的蓝色和绿色圆圈)的印迹。通过这种方式,神经元被合并到事件1和2。由于合并,这两个记忆被链接在一起。但若是一段时间后,分配给支持事件1的印迹的神经元变得比其邻居的兴奋性降低(“不应期”),如果事件2在此时间段内发生,一群新的更具兴奋性的神经元赢得了分配给支持事件2的印迹的竞争。这种错位使得两个记忆可以分别记忆。带有红色虚线轮廓的圆圈表示兴奋性较低的神经元。
在经历中比其邻居更容易兴奋的神经元,更有可能被分配为支持该经历记忆的印迹。在经历之后,印迹细胞增高的兴奋性也可以保持几个小时。因此,如果在此时间窗口中发生了相关的经历,则这些相同(或重叠)的印迹细胞比它们的邻居更兴奋,因此会合并到支持第二次经验记忆的印迹。由于两种经历的记忆被合并到重叠的印迹细胞中,因此这两种记忆成为链接(或集成)的;此时想到一个经验会自动使人想到另一个。例如,如果第二个事件发生在第一次事件发生后的几分钟到几小时(30分钟到6小时)而不是24小时后,则分配给第一个恐惧记忆的LA神经元将并置到第二个恐惧记忆中。即使在两次训练中使用的刺激条件具有不同的模式(例如,灯光和声音或环境和声音),也会发生这种联系。类似地,如果暴露于两个不同环境的时间间隔很短,则可以观察到支持两个不同环境记忆的CA1印迹细胞的合并。即使第二个记忆没有被行为消退,从行为上消退第一个记忆也会导致第二个记忆的消退,这表明两个记忆在功能上是相关的。共享的记忆可能通过印迹细胞间不同的突触来保持其独特的身份。此外,除了整合两个相似的记忆(两个恐惧记忆或两个情境记忆)之外,通过对记忆进行重复提取,还可以整合两个厌恶性的但又不同的记忆(如条件恐惧和条件味觉厌恶记忆)。总体而言,来自啮齿动物实验的这些数据与人类记忆实验的结果相吻合,后者表明,事件经历的记忆表征或者随着时间遗忘,或者与相关的事件整合或链接,从而允许记忆的泛化或者灵活共享信息。
记忆提取也可以瞬时重新激活印迹细胞。兴奋性的增加既提高了记忆提取的准确性和效率,又打开了一个新的“印迹分配窗口”,这也许可以解释新信息如何被整合到现有知识中的。
结论与观点
总的来说,这些研究为啮齿动物脑中存在的印迹提供了极具说服力的证据。我们同意Endel Tulving的观点,他说:“作为科学家,我被强迫得出结论,而不是假设,不是猜想,而是得出结论,即神经组织中一定存在与信息存储相对应的某些物理化学变化。这种变化是构成记忆的必要条件。(另一种立场是,任何行为或任何想法都可能独立于神经系统的物理变化而发生,正如所有的读者都知道的那样,这是纯粹的神秘主义)”。使用不同的方法来检查不同类型的记忆的不同实验室的结果都支持一个观点,即复杂的信息可能不是以单个细胞来表示的[例如,“祖母细胞”];相反,这些研究结果表明,在大脑中计算的基本单位是一个印迹。
要了解复杂的多层系统(例如大脑),至关重要的是将较低复杂性级别的过程或现象与较高复杂性级别的过程或现象的因果性联系起来。历史上,已经使用诸如组织损毁或药理破坏等干预措施进行了此类研究。本综述中讨论的许多研究都利用了最新的干预技术及其组合,包括时间可诱导的靶向转基因和光遗传学,这些技术通常可以确定更精确的因果关系。尽管如此,即使先进的干预措施也不可避免地人为地操纵了大脑,因此仅提供了有关印迹可以做什么的信息,但不一定提供它实际上的生理作用。很多关于记忆的综述都表达了这一观点。但是,这些干预研究的结果为我们应该集中精力去了解大脑实际形成和恢复记忆的哪些过程提供了方向。此外,从分子水平到行为水平的最新干预方法的高度特异性已经揭示了使用其他技术难以研究的机制。例如,这些人工干预研究使该领域能够识别印迹的沉默状态和记忆分配的基础机制。
一百多年前,西蒙提出了一项印迹形成法则。将这些理论思想与新的工具相结合,使研究人员能够在细胞集群水平上对图像进行成像和操作,从而有助于深入了解记忆功能。例如,有证据表明,内在兴奋性和突触可塑性的提高共同作用形成了印迹,这些过程在记忆链接、记忆提取和记忆巩固中也可能很重要。有趣的是,由于疾病过程(如用于研究AD的小鼠中)或导致健忘的药物(如蛋白质合成抑制剂)或某些自然行为(社交辨别记忆中的鼠笼状况)使印迹沉默,于是使普通的感觉线索无法再激活它们。但是,这些研究表明,沉默的印迹仍然存在于大脑中,它们所代表的信息可能并没有永远消失。心理学和行为学先驱爱德华·托尔曼发展了潜伏学习和潜伏记忆的概念:学习如果发生于没有强化的情况下,除非需要该知识或对该知识有动机,否则关于它的记忆将不会表达。确定一些潜在的记忆是否是基于沉默印迹是很有意思的,如果是,则可以将沉默印迹转化为激活印迹作为识别和表征介导相关动机的大脑回路的手段。
印迹可访问状态的连续统是可能存在的。即使通过人为手段,印迹也可能完全不可用且无法提取(可能记忆可能已经遗忘)。印迹也可能是沉默的,可以通过人为地重新激活印迹细胞来恢复记忆。使印迹沉默或擦除的过程以及使印迹解除沉默的策略是需要进一步研究的主题。可以通过人工激活有记忆缺陷的AD小鼠中的沉默印迹,这暗示了这一研究领域的非凡的转化潜力。
印迹研究还衍生了一些其他的研究主题。第一个主题是印迹研究的结果让人联想到再巩固研究。提取后,记忆可能会进入持续几个小时的不稳定且可修改的状态。重新稳定该记忆的过程称为再巩固。尽管再巩固的研究历史较长,但这种现象的重新重视源于纳德(Nader),勒杜(LeDoux)和沙夫(Schafe)的一项发现。在这项具有开创性的研究发表之前,普遍的想法是,记忆会在学习经历后不久发生的单次细胞巩固过程中稳定下来。但是,纳德(Nader)等人表明记忆提取将会打开几个小时的“再巩固窗口”,在此期间不同的干预措施可能会削弱或增强初始记忆,从而挑战了这一观点。例如,在条件恐惧记忆的再巩固窗口期间破坏蛋白质合成会产生明显的健忘症。该结果被复制和推广到数种类型的记忆研究中。这种再巩固阻断与印迹沉默之间有许多相似之处。例如,仅在主动提取记忆时才观察到再巩固阻断,因为在没有记忆重新激活的情况下施用茴香霉素(或其他类似干预措施)不会损害其随后的恢复。从“印迹概念框架”的角度来看,对特定记忆的提取将激活该记忆的印迹,而在此激活后不久破坏蛋白质合成,可能会使该印迹沉默。再巩固的功能可能是更新记忆。再巩固窗口与共分配窗口的相似性,表明这两个过程可能是在不同分析层次解释相同(或相似)现象的相似方式。
第二个新兴主题是竞争。在记忆编码时,给定大脑区域内可能分配为印迹的神经元之间会存在竞争。竞争是许多生物系统的基本特性,并且已证明在其他记忆现象中很重要。例如,记忆印迹可以在记忆提取时竞争行为的控制。此外,人类研究表明,如果不同记忆与某个常见的提取线索相关联,它们可能会竞争。目标记忆的提取可能导致当前不相关的竞争性记忆的遗忘。
尽管最近的印迹研究为记忆提供了重要的见解,但仍存在一些关键问题。首先,尽管大多数观察性研究表明,在训练和测试过程中激活的神经元群体之间的重叠数目超过随机水平,但这两个群体之间的总体对应性仍相对较低(大约为10%到40%,具体取决于研究)。这种重叠不会达到100%,表明存在许多可能性。首先,使用IEG启动子标记激活的神经元的方法可能不精确(在训练和/或测试时“过度标记”或“欠标记”“真实”印迹)。或者,印迹可能是动态的,即使是在相对较短的(几天)时间段内,当记忆精化或巩固时,细胞也“掉进”或“掉出”印迹。值得关注的是,确定印迹沉默的机制如何有助于该精化过程,且如何于该过程相互作用,以及这对记忆质量,准确性或强度的影响。此外,确定印迹在更长的时间内如何变化也很重要。例如,所有的印迹(具有不同效价的代表不同类型记忆的印迹,例如情景记忆,语义记忆,甚至程序性或运动性记忆)会随着时间的推移而变化,从而逐渐涉及更多的皮质区域吗?自上而下(mPFC到海马)的加工在海马印迹去成熟过程中是否起作用,以及沉默海马印迹在远期记忆回忆中的可能作用?
其次,我们如何利用对啮齿动物印迹的知识更好地理解人类的记忆?有充分的证据表明人类具有印迹样的记忆表征,但是迄今为止,在细胞集群水平上还没有令人信服的发现。为了将啮齿动物印迹研究的发现扩展到人类,有必要发展低侵入性甚至非侵入性的方法来在人类的单细胞或特定集群水平上对印迹进行成像和操作。记忆的提取会特异地再激活印迹细胞,利用记忆再巩固的机制,研究者在人类的“人造记忆操纵”的这个一般领域已经取得一些进展。在操纵人类记忆领域,利用药物阻断再巩固以及利用非侵入性技术在再巩固期间“更新”记忆已经获得一定的成功。
最后,神经科学和人工智能(AI)这两个领域之间的相互促进至关重要。了解大脑如何编码,存储和使用信息,尤其是在印迹的水平上,可以帮助发展更智能的机器。例如,大脑中的印迹和印迹如何用于链接记忆和组织信息可能会激发新算法和AI架构的发展。此外,机器学习和深度神经网络可能会激发或生成印迹水平的可验证的理论,供神经科学家进行研究。将AI先驱者Alan Turing的基础理论与Endel Tulving的基础理论相结合,可以使AI研究和记忆研究实现互利共赢。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。
